Каллюс на черенках
Каллюс у растений образуется вокруг места срезов или повреждений. Разрастаясь, он закрывает рану и служит таким образом для заживления ран и предохранения от загнивания. Новые корни у черенков появляются из каллюса или выше его, из стебля. Черенки разных растений укореняются с различной скоростью. Некоторые растения (колеус, фуксия,традесканция)укореняются быстро, в течение 5-7 дней, другие же (большинство хвойных) требуют для укоренения нескольких месяцев. Большинство растений укореняется в течение двух-трех недель.[ …]
Процессы каллюсо- и кор-необразования на черенках тесно связаны с их размерами. Чрезмерное увеличение длины черенка уменьшает коэффициент размножения. Слишком большие черенки имеют много листьев, которые испаряют значительное количество влаги, снижая оводненность тканей всех органов черенка (стебля, почек), что ухудшает укоренение. Черенки слишком малого размера (2—3 см) медленно укореняются, слабо развиваются. Технологически обоснован черенок длиной 15—25 см. Нижнюю часть черенка (1,5—3 см) заглубляют в субстрат, остальная часть, несущая листья, обеспечивает процесс регенерации.[ …]
Культура каллюса. Культура каллюса включает индуцирование и рост тканей каллюса и дифференциацию органов, что в конечном итоге должно привести к образованию вполне развитого растения. На первом этапе у растений стимулируется недифференцированный рост, или образование каллюса. Эти относительно равного диаметра и быстро делящиеся клетки обычно возникают в результате активного деления клеток на поверхности среза, но могут происходить и от единичных клеток. Недавно даже у пыльцевых зерен было вызвано придаточное образование тканей каллюса. Переход от роста к дифференциации органов у каллюса можно вызвать изменением среды после образования предельной массы его тканей. Во многих случаях критическим фактором является концентрация и баланс ауксина и цитокинина (см. гл. 4). Высокий уровень ауксина стимулирует возникновение зачатков корней, а высокий уровень цитокинина — побегов.[ …]
После образования каллюса ежедневно утром и вечером для притока свежего воздуха на 20-30 минут стакан или банку устанавливают на палочку толщиной в палец. С появлением первых корешков укрытие снимают вечером на 1-2 часа. С образованием корней покрышку совсем снимают.[ …]
В обоих случаях цитокинины не могут быть заменены другими пуринами, пиримидинами, аминокислотами, ауксинами и гиббереллинами. Помимо цитокининов активность была обнаружена только у дифенилмочевины [8]. Однако нет гарантии, что в растениях не существуют какие-то вещества, которые окажутся активными по отношению к этим тестам.[ …]
Наиболее благоприятна для образования каллюса температура 27—29° С. При зимних прививках, когда компоненты находятся в состоянии покоя, законченные прививки лучше всего хранить в течение одной-двух недель в теплых и влажных условиях, чтобы стимулировать образование каллюса.[ …]
Прямая пропорциональность между сырым весом каллюса и концентрацией кинетина сохраняется в пределах от 0,004 до 10 мг!л этого вещества, что соответственно равно 0,2—500 мкг кинетина на пробу.[ …]
В качестве слабых сторон тестов на цитокинины с каллюсами следует отметить два момента: длительность времени, нужного для количественной оценки кининовой активности, и необходимость стерильных условий работы. Содержание питательных элементов (в мг!л среды) для культивирования изолированных тканей стебля табака и каллюса семядолей сои следующее [8].[ …]
Как показали эксперименты с тканевыми культурами каллюса табака, фитохромная система может оказывать некоторое влияние па размножение вируса кольцевой пятнистости табака [1419]. Ежедневное воздействие на зараженные культуры красного света в течение 5 мин, проводимое на протяжении 2 нед, повышало содержание вируса на 50 % по сравнению с культурами, выращиваемыми в темноте. Дополнительное ежедневное воздействие красного света в течение 5 мин предотвращало это повышение содержания вируса в тканях.
лучение растений синим светом как до, Taxi и после инокуляции приводило к повышению содержания Z-вируса картофеля в тканях зараженных растений N. tabacum и вируса мозаики люцерны — в тканях N. clevelandii [335]. На основе экспериментов по влиянию распыленных растворов сахаров на листья сахарной свеклы было высказано предположение, что воздействие света на проявление симптомов желтухи сахарной свеклы связано с изменением содержания углеводов в зараженных листьях [1871]. Симптомы заболевания были более отчетливо выражены у растений, листья которых ежедневно опрыскивали 10%-ным раствором сахарозы. Высокая интенсивность света нодавляет образование опухолей на стеблях и корнях растений какао, зараженных вирусом деформации побегов дерева какао [38]. В Гане, где деревья какао часто бывают затенены другими высокими деревьями, болезнь эта проявляется в общем значительно сильнее, чем в Нигерии, где деревья какао получают больше света.[ …]
Кассашгс и Тинсли [951] сообщают об освобождении культуры каллюс-ной ткани табака от У-вируса картофеля путем добавления к питательной среде 2-тиоурацила (в концентрации 2 мкг/мл). Добиться регенерации растений картофеля из безвирусной каллюсной ткани не удалось.[ …]
Некоторым растениям, например винограду, для образования каллюса необходим кислород. Такие растения не следует обмазывать садовым варом, чтобы не препятствовать доступу кислорода.[ …]
Существует несколько модификаций биотеста на цитокинины, основанного на стимуляции ими роста каллюса в изолированной стерильной культуре. Стерильность дает этому тесту большое преимущество, так как исключает побочное влияние микроорганизмов. Вместе с тем необходимость стерильных условий ограничивает широту его применения. Используют общие положения работы со стерильной культурой тканей, которые подробно изложены в монографии Бутенко [12].[ …]
По некоторым данным, красный свет эффективнее, чем белый.[ …]
Процесс выделения еловой живицы непосредственно из ранения называется первичным смоловыделением, а из каллюса — вторичным. Такое выделение может продолжаться довольно долго, до тех пор пока не зарастет рана. Особенностью смолоносной системы ели является уменьшение густоты смоляных ходов с высотой ствола, причём на южной стороне в нижней и средней частях ствола смоляных ходов значительно больше, чем на северной.[ …]
Вместо сердцевины стебля табака ряд авторов при определении кининов используют в качестве тест-объекта стеблевой каллюс табака [8]. Однако для этой цели подходят не все сорта табака. Хорошие результаты получены в лаборатории Скуга [8] с каллюсом табака Висконсин 38, тогда как некоторые сорта образуют каллюс, который хорошо растет и в отсутствие цитокининов.[ …]
При поранении корней вяз дает иногда корневые отпрыски. После срубки на пнях между корой и камбием образуются валики каллюса, в котором закладываются придаточные почки, развивающиеся в поросль. Помимо этой (адвентивной) поросли, вяз дает и превентивную (из спящих почек).[ …]
Наряду с опрыскиванием нужно и проветривание. Систематически проветривать начинают только с появлением на черенках каллюса, до этого проветривание считается достаточным во время снятия покрышки при опрыскивании растений.[ …]
Срастание компонентов является основой прививки. Совершается оно перемешиванием и смыканием тканей каллюса, образующегося из камбия подвоя и привоя как реакция на поранение. Камбий — меристематическая ткань между ксилемой (древесина) и флоэмой(кора) — у многолетних древесных двудольных растений тянется непрерывно. Однодольные растения с рассеянным камбием не могут быть привиты. Ткани каллюса состоят из паренхимных клеток. Под влиянием имеющегося в наличии камбия ткани каллюса дифференцируют новые камбиальные клетки. Этот новый камбий, в свою очередь, вызывает дифференциацию ксилемы и флоэмы для восстановления сосудистой связи между подвоем и привоем (рис. 124). Основой техники прививки является создание тесного контакта между камбиальными тканями подвоя и привоя с тем, чтобы образующиеся у них ткани каллюса срастались и создавали прочную связь. Часто упругость привоя или подвоя используется для выполнения прививки в расщеп. Чтобы обеснечить более плотное прилегание компонентов, применяют обвязку тесьмой, резиновой лентой или закрепление гвоздями. Различные виды окулировки и прививки изображены на рисунках 125 и 126. Естественные прививки образуются в результате тесного переплетения корней или стеблей.[ …]
Черенки укореняются лучше при рассеянном свете, который создают притенением их бумагой или занавеской. Притенение уменьшают с появлением каллюса и удаляют полностью после образования корней. Легкое притенение в солнечные дни нужно и для укорененных растений, не выдерживающих прямых солнечных лучей (гортензия, прогула и др.). Укоренившиеся черенки не следует долго держать в песке, так как появившиеся на них молодые побеги от недостатка питания начинают деревенеть, а из-за недостатка света — вытягиваться, поэтому их следует высаживать в горшки с землей, наиболее отвечающей требованиям растения.[ …]
Растительные клетки можно выращивать в культуре несколькими способами: выращивают либо целые органы (например, корни или верхушки стеблей), либо ткань каллюса, либо, наконец, клеточные суспензии. Все эти способы были испробованы при изучении репликации вирусов, однако результаты оказались неутешительными (если не считать некоторых микроскопических исследований). Количество вируса, продуцируемого в культуре ткани, обычно намного ниже, чем в интактных зеленых листьях.[ …]
В условиях культурных плантаций применяют низкую резку, оставляя пенек высотой 2…3 см. Новые придаточные почки закладываются в разросшейся возле среза защитной ткани — каллюсе. Здесь же нередко вырастают и придаточные корни. Недостатком низкой резки является то, что развивающийся побег прикрепляется к материнскому черенку сбоку и легко обламывается.[ …]
Широкие перспективы для применения в садоводстве имеют стимуляторы и ингибиторы роста растений. Так, например, кинетин (6-фурфуриламинопурин) активирует клеточное деление и, по-видимому, стимулирует образование каллюса. Способность гиббереллинов стимулировать рост используется для увеличения размера сельдерея. Не меньшее значение имеют вещества, подавляющие или задерживающие рост. Использование гидразида малеино-вой кислоты для замедления роста дерна с целью сократить частоту скашиваний не нашло практического применения, но стимулировало поиски других веществ подобного действия.[ …]
В отличие от сосны у ели хорошо развит смоляной аппарат коры. Основная масса живицы выделяется из мест соприкосновения обнажённой древесины с корой при нанесении подсочных ранений. В результате ранений во вновь образующейся древесине наплыва (каллюсе) возникает большое количество патологических смоляных ходов, превышающее в 2-3 раза обычное количество смоляных ходов в древесине. У основания каллюса образуется особый слой выделительных (железистых) клеток. Он располагается на внутренней плоской стороне каллюса и «подстилает» его на поверхности ранения.[ …]
Упакованные прививки переносят в стратификационную камеру. Оптимальная температура для срастания 20—25°С. Влажность воздуха поддерживают на уровне 85% и выше. В таких условиях прививки выдерживают 10—17 дней.
к только компоненты срастутся (образуется каллюс в месте прививки) и начнут формировать мелкие белые корешки на корнях, прививки переносят в помещение с температурой минус 1—0°С, чтобы предупредить прорастание почек на черенке. В таких условиях их хранят до посадки на первое поле школы саженцев. Очень важно поддерживать в» заданных параметрах температурный режим, так как при ее повышении до 3°С усиливаются ростовые процессы, а при снижении до минус 6°С повреждается каллюс. При подсыхании опилок их увлажняют. После стратификации прививки можно также хранить в снежнщх буртах.[ …]
Корневые черенки и отрезки стволиков (диффенба-хии, драцен и др.) сажают в рыхлую садовую землю с примесью песка так, чтобы только верхние концы оставались непокрытыми землей. Появлению корней у черенка предшествует образование на нижнем срезе черенка особого наплыва ткани — каллюса.[ …]
Придаточные корни и побеги могут возникать из различных тканей. Например, у узамбарской фиалки корни на листовых черенках возникают из клеток, расположенных между сосудистыми пучками, а побеги — из клеток эпидермиса или коры. У батата корни и побеги могут образоваться из тканей каллюса на поверхности среза.[ …]
В принципе суспензии живых, но не делящихся клеток обеспечивают экспериментатору ряд преимуществ при изучении репликации вирусов; однако на практике действительно эффективной системы такого рода до сих пор предложено не было. Можно использовать также разобщенные клетки из ткани каллюса, растущие в культуре, или клетки листьев, разделенные ферментативной обработкой [1972].
лючение радиоактивных предшественников в ВТМ исследовалось на группах клеток из листьев [300]. С этой целыо инфицированные листья измельчали при контролируемых условиях так, чтобы от 30 до 50% клеток оставались интактными. В этих гомогенатах синтезировался меченый вирус. Изменения, вызываемые в клетках гомогенизацией, вероятно, довольно серьезны, однако они не были изучены.[ …]
В отсутствие цитокининов каллюсообразования у сердцевины стебля табака практически не происходит. Оно начинается только в пробах, содержащих цитокинин. Обнаружить начало процесса под микроскопом можно уже через 2—4 дня, однако обычно о действии цитокининов судят по приросту сырого и сухого веса каллюса через 4—5 недель с момента посадки. Для определения веса каллюс переносят из колбы в бюкс и взвешивают, чтобы узнать его сырой вес. Затем его доводят в термостате при 105° до постоянного веса и определяют сухой вес. В определенном пределе концентраций обнаруживается линейная зависимость между весом каллюса и концентрацией цитокинина. При более низких концентрациях действие цитокинина не проявляется, а при более высоких — может наблюдаться снижение эффекта. Абсолютные значения стимулирующих концентраций меняются в зависимости от взятого цитокинина.[ …]
Ауксины и гиббереллины могут при некоторых условиях стимулировать деление клеток, однако вх скорее можно назвать гормонами, регулирующими рост растяжением. Было показало, что клетки каллюса в стерильной культуре через определенный промежуток времени прекращают деление. Однако при добавлении к питательной среде производных ДНК, получающихся после ее авто-клавнрования, деление клеток возобвовляется.[ …]
Каждому практически опытному садоводу известно, что кольцевание ветви какого-либо древесного растения ведет к тому, что выше снятия кольца коры с ветви при достаточной защите места операции сырым мохом, песком или землей для более скорого заживления и сращения разъединенной коры, на всей длине ветви развиваются плодовые почки, а в месте снятия коры появляется каллюс и в большинстве развиваются корни, из чего вытекает заключение, что сделанный таким образом отводок должен иметь в себе уже зачатки к развитию плодовых деталей, что в свою очередь при повторении в нескольких генерациях отводков от отводков ведет к достижению ускорения плодоношения гибридом.[ …]
Культура тканей представляет собой стерильный рост тканей или органов в искусственной среде. Хотя культура тканей долгое время была уделом физиологов, но в последнее время эта техника все больше используется как способ размножения растений. Существуют два типа размножения растений культурой тканей (называемой также микрокультурой): культурой меристем и культурой каллюса.[ …]
Массовым видом огневого ранения при низовых пожарах являются травмы в виде опалов коры и поражения под нею камбия в нижней части стволов. Наружный опал (нагар, обгар) коры часто свидетельствует и о поражении камбия. В результате образуется так называемая пожарная подсушин а. Удалив кору, можно точно установить наличие и размер ранения. На краях скрытой корою подсушины (рис. 7) формируется каллюс и ранение начинает зарастать, при этом опадение коры на месте подсушины ускоряется и последняя обнажается, но не полностью, так как к этому времени края ее уже скрыты послепожарными отложениями прироста. Такие деревья с пожарными подсушинами в некоторых районах на севере! называют образно «пологрудыми».[ …]
У черенков привоя и подвоя, заготовленных с молодых, активно растущих побегов с интенсивно фотосинтезирующим листом, срастание и укоренение проходит одновременно и продолжается около 3 недель. Визуальные наблюдения и анатомические исследования привитой вишни показали, что через неделю после посадки в зоне прививки после отмирания поврежденных тканей возникают меристематические очаги, в зоне корнеобразования появляется каллюс. Через 2 недели в месте прививки образуются слои новых клеток, в базальной части подвоя появляются корни. В конце 3-й недели в зоне срастания формируется проводящая система.[ …]
Перед посадкой черенки кильчуют в парниках, траншеях. Вниз набивают снег или лед, на который устанавливают решетку, а на нее — верхними концами черенки. Нижним концам создают температуру до +30° С. Черенки укрывают песком, слоем 2—3 см, а затем перегнойной землей — 3—4 см. Парники закрывают стеклянной рамой, а на ночь — матами. Черенки поливают водой, подогретой до +45… +50° С. Через 2—3 недели на нижних концах появляются белые бугорки каллюса (наплыва) и зачатки корней, а нижние почки, которые находились возле льда и снега, не распускаются. Под каждой рамой парника (106 х 160 см) размещают 4—5 тыс. черенков.[ …]
В каллтосшлх культурах зараженных тканей концентрация вируса обычно значительно ниже, чем в интактных тканях растений. Вирус был обнаружен лишь примерно в 40% всех проверенных клеток. Удалось подтвердить и другим путем, что некоторые клетки действительно не содержали вируса: часть выращенных из каллюса растений табака оказалась свободной от вируса.[ …]
В зараженных ВЯ?МТ листьях китайской капусты, взятых для исследования через 12—20 дней после заражения, увеличение содержания вирусного фосфора сопровождалось соответствующим снижением содержания нерастворимого невирусного фосфора (фиг. 43). Это наводит на мысль о том, что вирус использует (не обязательно непосредственно) часть запасов нерастворимого фосфата листьев. При устоявшейся инфекции ВЖМТ может содержать около 20% общего фосфора листа. В листьях N. glutinosa и в ткани каллюса N. tabacum, зараженных ВТМ, наблюдалось изменение концентрации некоторых нуклеотидов¿[1707—1709].[ …]
Кора — это участок между сосудистой системой и эпидермисом. Она образуется из первичных тканей, преимущественно из паренхимы. В старых одревесневших стеблях образование пробковых тканей в коре с последующим отмиранием наружних слоев стирает признаки обособления коры. Пробковая ткань начинает формироваться, когда достигшая полного развития ткань становится мери-стематической и образует клетки с опробковевшими стенками. Этот защитный пробковый слой известен как перидерма. Каллюс, образующийся в ответ на ранение тканей, также может стать опробковевшим. Пробковая промышленность основывается на использовании такой ткани, образующейся в больших количествах у пробкового дуба (Quercus súber).[ …]
Скорость зарастания ран составляет примерно 1 см диаметра в год, Поэтому для предупреждения загнивания древесины все раны диаметром более 1 см замазывают садовым варом. Хороший садовый вар легко наносится на раны при пониженной температуре, xopou.ro прилипает к свежим срезам, в течение длительного времени не высыхает и сохраняет эластичность, не растрескивается на морозе, в жаркую погоду не растапливается и не стекает, не ожигает ткани коры и камбия. Желательно, чтобы он стимулировал образование каллюса и зарастание ран, поэтому часто в него добавляют ростовые вещества.[ …]
Соотношение температур субстрата и воздуха должно изменяться в зависимости от фазы укоренения черенков. В первую фазу корнеобразова-ния, когда формируются зачатки корней в тканях черенка, температура субстрата должна быть на 2—3°С выше, чем температура окружающего воздуха. Это активизирует физиологические процессы в нижней части черенка за счет оттока пластических веществ из верхней части к месту корнеобра-зования. Наблюдается быстрое утолщение нижней части черенка в результате активного деления клеток, ткани коры приобретают беловатый оттенок, на срезе по камбиальному кольцу образуется каллюс.[ …]
Аномальные митозы и мейозы можно вызывать с помощью различных механических воздействий, в том числе и декапита-цией, т. е. удалением верхушек побега. Опыты Винклера (1916) по искусственному образованию полиплоидных форм методом прививок весьма интересны, поскольку на полученных им тет-раплоидах удалось показать, что различия в числе хромосом приводят к морфологическим изменениям. Причиной возникновения полиплоидов в опытах этого ученого были не прививки, ■а поранения растений, стимулирующие митотическое деление. Регенерация, т. е. восстановление утраченных или поврежденных органов и тканей, а также восстановление целого организма из отдельных тканей, происходящая за счет каллюса рубцевания, иногда приводит к образованию некоторого числа тетраплоидных побегов; именно поэтому декапитацию широко применяют у растений, способных к регенерации. Этот метод особенно эффективен для некоторых пасленовых, например, томатов.[ …]
С ростовыми корреляциями тесно связана способность растительных организмов к регенерации, или восстановлению утраченных частей. Высшее проявление регенерационной способности растений проявляется при культуре изолированных клеток и тканей. Однако в этом случае для регенерационных процессов нужны особые стерильные условия, специальная питательная среда и определенное соотношение гормональных веществ, внесенных извне. Несколько иное положение наблюдается при черенковапии растений. В этом случае регенерационные процессы не требуют особых условий. Регенераци-оппая деятельность при черенковании начинается с усиленного деления клеток на месте среза, в результате чего образуется наплыв — каллюс. Особенно энергично деление клеток происходит вблизи ситовидных трубок. Затем клетки каллюса дифференцируются, закладываются точки роста и развиваются придаточные корпи. Для развития стеблевого побега необходимо наличие почки. На черенках очень сильно проявляется влияние полярности. Каллюс образуется только па лижпем конце черенка. По-видимому, полярность связана « распределением гормонов, так как с помощью ауксина можно вызвать образование каллюса ва морфологически верхнем конце черенка. Черенки сохраняют на себе отпечаток возраста растительного организма, от которого они отделены. Так, черенки, взятые с цветущего растения, раньше образуют цветочные зачатки. Способность растений к регенерации широко используется в практике растениеводства при вегетативном размножении растений.[ …]
Методы выращивания изолированных тканей были разработаны Ф. Уайтом и Р. Готре. Сущность метода заключается в том, что выделенные кусочки ткани или отдельные клетки выращивают на искусственной питательной среде в стерильных условиях. Если полностью дифференцированную клетку изолировать, то в стерильпых условиях на соответствующей питательной среде она снова начинает делиться и затем из нее может развиться целый растительный организм. Так из одной, полностью дифференцированной клетки флоэмы, выделенной из корнеплода моркови или из клетки сердцевинной паренхимы табака, можно получить целое, полностью развившееся растение. В опытах советского физиолога Р. Г. Бутенко с клетками флоэмы моркови при выращивании на питательной среде в стерильных условиях сначала удалось заставить их делиться и получить недифференцированную массу клеток — каллюс. Затем в этой массе клеток возникли очаги дифференциации. Процесс вторичной дифференциации можно разделить на две фазы, первая фаза — ью образование в массе однородных клеток очагов регенерационной меристемы и возникновение зародышевых структур, которые напоминают настоящие и имеют зачаточную почечку и зачаточный корешок. Для того чтобы зародышевые структуры появились, необходимо добавление фитогормонов цдтокининов. На второй фазе происходит рост этих зародышевых структур, но для этого необходимо добавить в питательную среду ауксины. При этом в зависимости от соотношения ауксинов и цитокининов происходит преимущественный рост тех или ниых органов.[ …]
Источник: ru-ecology.info
Широкое применение различных методов вегетативного размножения, особенно размножения черенками, а также прививок, выполняемых с разнообразными целями, побуждают исследовать те структурные процессы в каллюсах, которые определяют образование придаточных корней и почек в черенках и срастание в прививках. Можно объяснить только общие принципы соответствующих структурных процессов вследствие слабой изученности анатомической стороны методов черенкования и прививок.
На всяком срезе стебля, корня, а иногда и листа, если участки этих органов со срезами помещены в соответствующие благоприятные условия температуры и влажности, через некоторое время образуются наросты ткани беловатого или желтоватого цвета, которые по сходству их с мозолями называют мозолем, или каллюсом. В таких мозолистых, или каллюсовых наростах со временем возникают корешки и почки новых побегов. Каллюс образуется также при заживлении нанесенных растению ран и при срастании привоя с подвоем.
Начало возникновения каллюса принципиально возможно во всех растительных тканях, где в достаточном числе сохранились живые клетки. На отрезках осевых органов, стеблей или корней каллюс может образоваться из различных клеток коры, из древесины или сердцевины. Даже на разрезах таких тонких органов, как листья, при соответствующих условиях вполне может образоваться каллюс, только не столь заметный (вследствие малых размеров), как на срезах стебля и в особенности корня. На разрезах древесины каллюс образуется из тилл, заполняющих полости сосудов, и из клеток древесинной паренхимы. Но особенно легко и быстро каллюс возникает из меристематических тканей или тканей, способных быстро переходить в меристематическое состояние, в частности из камбия и перицикла.
До сих пор у самых разнообразных растений не найдено никаких особых отличий в структуре ткани каллюсов. Всюду эта ткань состоит из паренхимных клеток весьма разнообразных размеров и очертаний, расположенных как будто бы беспорядочно. Клетки каллюса вполне живые, нередко с хорошо заметными клеточными ядрами. Хотя межклетники в каллюсовой ткани развиты очень слабо и встречаются лишь изредка, однако эта ткань не меристематическая: на последнее указывают относительно толстые клеточные оболочки. Но, не имея характерных внешних признаков меристемы, ткань каллюса легко переходит в меристематическое состояние. В отдельных местах каллюсовой ткани под воздействием того или другого раздражителя возникают новые клетки. Кроме того, в больших вакуолях каллюсовых клеток, по-видимому, содержатся вещества, способные послужить источником питания для всех новообразований, возникающих в каллюсах до тех пор, пока последние не включаются в общую проводящую систему или не начнут жить самостоятельно. При образовании структуры каллюсовой ткани из нее может возникнуть любой орган растения. В смысле образовательной способности ткань каллюса весьма многогранна (тотипотентна) и при этом содержит в себе вещества, необходимые для начального развития возникающих органов.
На поверхности каллюса, хотя ткань его и однообразна, часто намечается подобие покровной ткани, состоящей из более мелких и морфологически совершенно однородных клеток, несколько похожих на таблитчатый тип эпидермиса, но без устьиц. Спустя некоторое время поверхностные клетки каллюса подсыхают, образуя подобие одного слоя пробковой ткани, или же слущиваются, заменяясь новыми слоями каллюсовой ткани.
В своем распространении ткань каллюса не ограничивается только поверхностью среза, но возникает и на некоторой глубине тканей черенка. Делению подвергаются паренхимные ткани, расположенные в коре черенка, камбий и перицикл. Раздражение, исходящее от первично образовавшейся каллюсовой ткани, с расстоянием ослабляется; чем глубже лежат ткани по оси черенка, тем энергия образования каллюсоподобных клеток слабее. В итоге массив каллюсовой ткани приобретает очертания клина, как бы вонзающегося своим острым кондом в толщу ткани черенка.
На рисунке изображена схема продольного разреза верхушки черенка шиповника с двумя клиньями каллюсовой ткани: первый клин — между первичной корой (2) и лубяными волокнами (3); второй клин более обширный, изображена только верхушка — между лубяными волокнами и древесиной центрального цилиндра (4). Такая клинообразная в продольном сечении ткань окружает кольцом весь цилиндр древесины в верхушке черенка, а также оторачивает кольцо лубяных волокон, обнаруживаясь на поверхности сначала двумя концентрическими кругами. Вскоре круги каллюсовой ткани разрастаются, сливаясь на поверхности среза черенка в одну общую кольцевую массу.
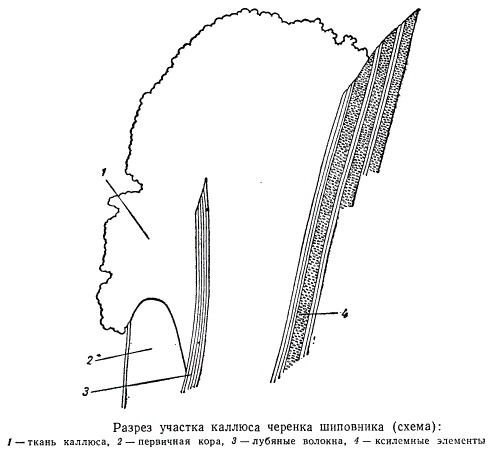
По существу срастаются друг с другом отдельные кольца каллюсовой ткани. В то же самое время в определенных участках каллюсовой ткани начинается процесс дифференциации клеток. Выше уже отмечалось, что каллюсовые клетки вполне жизнедеятельны. Особенно выделяются своей жизнеспособностью эмбриональные клетки каллюса, образовавшиеся в вышеописанных клиньях. По-видимому, эти качества зависят от того, что клетки, заполняющие клинья, произошли от камбия и перицикла и непосредственно связаны с основными образовательными тканями центрального цилиндра.
На рисунке изображена часть поперечного разреза каллюса шиповника, расположенная в толще клина. Клетки каллюсовой ткани, с первого взгляда столь беспорядочно нагроможденные в месте среза, в области клина располагаются правильными рядами, послойно размещенными между тканью первичной коры (1) и перициклическими волокнами (3).

В такой ткани особенно легко возникают участки меристемы каллюса. Возможно, что меристема с определенной направленностью деятельности распространяется горизонтально от живых клеток центрального цилиндра. В итоге из возникших в отдельных местах каллюса меристематических участков начинают формироваться первые элементы сосудистой системы — трахеиды, а около них, кнаружи, т. е. в сторону первичной коры, — ситовидные трубки. На продольном разрезе верхушки черенка образовавшиеся трахеидоподобные клетки расположены цепочкой; около них цепочкой же располагаются вновь образовавшиеся ситовидные трубки. От первичной коры каллюс отделен слоем кристаллоносной паренхимы.

Участок тяжа, состоящего из трахеидоподобных клеток и ситовидных трубок, при несколько большем увеличении изображен на рисунке. Клетки ситовидных трубок отличаются от клеток прочей паренхимы каллюса своей вытянутостью и соответственно более мелким просветом. Трахеидоподобные клетки принадлежат к широкораспространенному типу водоносных элементов, называемых гидроцитами. Гидроциты каллюса отличаются от водоносных анатомических элементов других типов тем, что в них сравнительно долго сохраняются клеточные ядра, хотя утолщения их оболочек одревесневшие. Одревеснение клеточных оболочек отнюдь не обязательно связано с разрушением живого протопласта клеток. Например, клетки древесинной паренхимы, с определенно одревесневшими оболочками, часто вполне жизнедеятельны, имеют клеточные ядра и способны к делению. В члениках сосудов, а также у большинства типов трахеид живое содержимое клеток отмирает и разрушается.
На рисунке изображено два участка ткани, содержащей гидроциты, в которой местами прекрасно различимы клеточные ядра, а на другом рисунке — длинный гидроцит с тремя сохранившимися клеточными ядрами и участками протопласта, съежившимися, однако, при приготовлении препарата и поэтому отставшими от оболочки. От одного из клеточных ядер к периферии цитоплазмы тянутся цитоплазменные тяжи. Длинные гидроциты, как и ситовидные трубки, могут быть многоядерными.

Среди гидроцитов каллюса, представляющих собой отдельные клетки, соединяющиеся друг с другом окаймленными порами сетчатого типа, есть как паренхимные, так и прозенхимные элементы.
Гидроциты каллюсовой ткани, имея на стенках одревесневшие утолщения с сетчатыми окаймленными порами, являются типичными водоносными анатомическими элементами, способствующими более быстрой подаче воды, чем обычные паренхимные клетки каллюсовой ткани, в результате чего в каллюсе формируется полноценный проводящий пучок.
Процесс превращения каллюсовых клеток в гидроциты, начинающийся в глубине клина, распространяясь, постепенно достигает участков, близких к периферии каллюса, давая ответвления по всем направлениям. В итоге недалеко от периферии каждый тяж, состоящий из гидроцитов и примыкающих к ним ситовидных трубок, оканчивается скоплением гидроцитов, окантованных слоем клеток с густым цитоплазматическим содержимым, несколько напоминающих меристему. Такие скопления гидроцитов и меристемоподобных клеток имеют вид узлов или компактных скоплений. Гидроциты в таких узлах заметно короче, чем в тяжах, идущих из глубины клина, вместе с будущими ситовидными трубками они анастомозируют с подобными же элементами соседних узлов таких расширений, образуя в общем связную систему проводящих элементов.

На рисунке представлен поперечный разрез через каллюс черенка кок-сагыза, проведенный несколько отступя от поверхности наплыва. В каллюсе кок-сагыза образуются такие же скопления гидроцитов (1), как и у шиповника, только у кок-сагыза они окружены кольцом будущих млечников, непосредственно примыкающих к будущим ситовидным трубкам (2). Если срез провести несколько выше узлового скопления гидроцитов, то он захватит только верхушку ткани млечников (5).

Гидроциты в каллюсе кок-сагыза образуют довольно плотную ткань, переплетаясь друг с другом в узлах. Будучи продолжительное время живыми, окруженные живыми элементами флоэмы и млечников, гидроциты представляют собой мощную систему, проводящую воду и пластические вещества, которая дает возможность быстро развиваться зачаткам побегов и корней. На «поперечном разрезе гидроцитного узла расположение составляющих его анатомических элементов не меняется по сравнению с продольными разрезами.

В мощных каллюсовых «наплывах от гидроцитных узлов первого порядка отходят тяжи гидроцитов, заканчивающиеся, в свою очередь, гидроцитными узлами второго порядка, от которых также могут отходить гидроцитные тяжи следующего порядка. В итоге в каллюсовой ткани, просуществовавшей более или менее продолжительное время, может развиться весьма сложная система гидроцитных образований.

Как было указано выше, поверхностные клетки каллюса претерпевают ряд характерных морфологических изменений, образуя ткань, подобную Пробке. При этом происходит не только отмирание и отсыхание самых наружных клеток. Часто и более глубокие слои каллюса превращаются в такую же ткань. Возможно, что отмирание наружных клеток ведет к образованию из лежащих под ними живых «леток пробковой ткани. Так как пробка принадлежит к категории защитных покровных тканей, то и ткань, образующуюся на периферии каллюса, можно назвать защитной. Защитная ткань в своем дальнейшем развитии может закладываться и в более глубоких слоях каллюса, приближаясь затем к периферии в местах выхода млечных трубок и понижаясь в промежутках между ними. Так как клетки защитной ткани образовались путем деления каллюсовых клеток и, опробковев, уже не разрастались, то они заметно мельче внутренних клеток каллюса и выделяются характерной для пробковой ткани легкой извилистостью клеточных оболочек, а также их более темной окраской.

Наряду с клетками, имеющими клеточные ядра, многие клетки защитной ткани содержат только воздух. Самые клеточные ядра сильно изменены: мельче размерами, стекловидные, без ядрышек, что значительно отличает их от клеточных ядер прочих каллюсовых клеток, расположенных ковнутри от защитной ткани. В клетках, расположенных кнаружи от защитной ткани, ядра разрушаются, причем сами клетки отмирают.
Вслед за описанными структурными процессами в каллюсах начинается дифференциация почек побегов и корней из меристематических участков, структурно связанных со всеми элементами, слагающими узлы гидроцитов, и примыкающих к ним слоев. Результаты такого образовательного процесса удобнее всего наблюдать на каллюсах, культивируемых изолированно от произведших их черенков; из таких каллюсов удается выращивать молодые растеньица. Разрез каллюса, культивируемого изолированно от черенка, приведен на рисунке.

На демонстрируемом полусхематическом рисунке показан участок мощного гидроцитного узла (1), соединяющегося гидроцитными тяжами с системой гидроцитных узлов и тяжей материнского черенка. Остаток такой связи показан на рисунке цифрой 2. От гидроцитного узла отходят ветви к формирующимся почкам (7), молодым розеткам листьев (6) и корням (5). Все это покрывает паренхима и слой мощной защитной ткани каллюса (5). Защитная ткань прерывается в местах образования почек, розеток листьев и корней.

Каллюс может возникнуть из ряда тканей черенка (камбий, перицикл, сердцевина и др.), причем мощность каллюса неодинакова у разных растений. Довольно слабый каллюс образуют, например, черенки гортензии. Корни закладываются здесь, как обычно, в перицикле. От иерицикла по направлению к сердцевине клетки сердцевинных лучей дифференцируются как гидроцитная ткань, образуя перемычки с граничащими с сердцевинным лучом сосудистыми пучками.
Такой же слабый, почти незаметный невооруженному глазу каллюс образуется на черенках гардении. Корни в этих каллюсах возникают с большим трудом и таким же порядком, как у гортензии.
При развитии мощного каллюса заложение корней происходит несколько иначе. На рисунке хорошо видно место отхождения молодых корней из базального конца черенка тополя. Проводящая система корней (2) непосредственно примыкает к гидроцитному узлу, являющемуся расширением гидроцитного тяжа, идущего из каллюсового клина, образовавшегося в камбиальной зоне черенка. Почки побегов возникают на верхнем полюсе черенка. К почкам подходит проводящая система — непосредственное продолжение гидроцитного тяжа, получившего начало из клина каллюса черенка.

Все вышеизложенное показывает, насколько сложны структурные процессы, развертывающиеся при укоренении черенков. Еще более сложны они в подвое и привое при различных приемах прививок. Остановимся на кратком разборе явлений срастания подвоя с привоем при прививках между представителями двух различных семейств: паслена (семейство пасленовые) и ирезине (семейство амарантовые). Прививка паслена на ирезине происходит с трудом, участки срастания тканей немногочисленны, вследствие чего картина срастания сравнительно проста и удобна для изучения. Принципы структурного причленения привоя к подвою в основном сходны при всех прививках.
Наиболее существенным для удачной прививки является процесс установления контакта сосудистой системы привоя и подвоя. Подвоем в рассматриваемом примере служит ирезине, привоем — паслен. Прививка производилась сближением (копуляцией) или в расщеп.
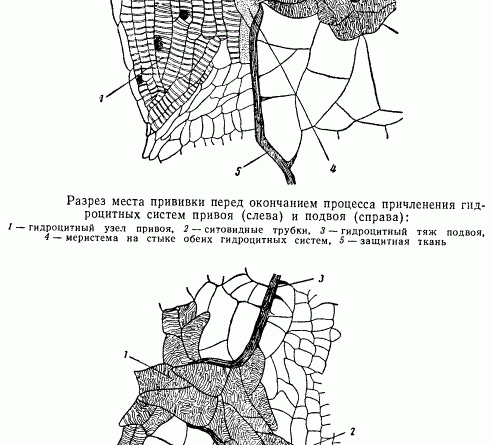
При соприкосновении поверхностей срезов подвоя и привоя через некоторое время и при соответствующих условиях в местах срезов образуется каллюс, разрезы которого изображены на рисунках. Направо расположен подвой (ирезине), налево — привой (паслен). Обычным порядком в каллюсе дифференцируются гидроцитные тяжи (1), пронизывающие толщу каллюса (на рисунке заштрихованы точками), идущие навстречу друг другу, от привоя к подвою. Гидроцитные тяжи состоят из таких же элементов, какие описаны в гидроцитных тяжах каллюсов черенков, т. е. из трахеидоподобных клеток, коротких и длинных, с примыкающими к ним элементами флоэмы. Как при возникновении каллюса в черенках, так и при прививках, каллюс на своей поверхности покрывается защитной тканью. Последняя в нашем примере прорывается только местами, поблизости от ненарушенных чрезмерно срезом участков центрального цилиндра привоя или подвоя. В эти-то прорывы защитной ткани и направляются гидроцитные тяжи, посредством которых осуществляется связь сосудистых систем привоя и подвоя.

На рисунке изображена одна из таких перемычек. К мощному гидроцитному узлу привоя (1), состоящему из вытянутых элементов, с примыкающим к этим элементам слева тяжем ситовидных трубок (2), направляется гидроцитный тяж подвоя (3). На границе стыка этих двух гидроцитных систем расположены меристематические клетки (4), возникшие из каллюса привоя. В итоге при благоприятных условиях осуществляется полный контакт проводящих систем привоя и подвоя. На рисунке видно, что защитная ткань в месте прорыва отогнута в сторону подвоя; это указывает на то, что из двух идущих навстречу друг другу тяжей, дифференцирующихся в проводящие элементы клеток каллюсовой ткани, один, принадлежащий каллюсу привоя, более мощный, и дифференциация клеток в нем происходит энергичнее. Клетки каллюса подвоя заметно крупнее клеток каллюса привоя, поэтому довольно легко разобраться в местах причленения друг к другу гидроцитных систем каждого члена прививки.
Кроме причленения проводящей системы при помощи дифференцирующихся из каллюса гидроцитных тяжей — универсальных анатомических элементов высших сосудистых растений — привой и подвой приходят в соприкосновение друг с другом еще поверхностями защитных тканей каллюсов каждого компонента прививки. По-видимому, здесь срастания не происходит, осуществляется лишь слияние в единую защитную ткань облитерированных, отмерших клеток. Защитная ткань остается без коренных структурных изменений на все время существования привитого растения, срастание же сосудистой системы с течением времени расширяется и углубляется.
Источник: www.activestudy.info