Хелатные соединения это
Лиганды, занимающие в координационной сфере одно место, называются монодентатными. Лиганды, занимающие в координационной сфере два или несколько мест, называются би-иполидентатными. Примерами монодентатных лиганд является NH3, полидентатные комплексные соединения образуют органические реагенты с металлами. К полидентатным соединениям относятся так называемые хелаты циклические или клешнеобразные соединения, в которых центральный атом и полидентатный лиганд образуют цикл. Комплексообразователь при этом оказывается как бы втянутым внутрь лиганда, охвачен связями наподобие клешней рака. Отсюда и происходит название хелат («клешни рака»). Как правило, хелаты лучше растворимы в органических растворителях, чем в воде и более устойчивы по сравнению с комплексами тех же металлов с монодентатными лигандами. Различают обыкновенные хелаты, в которых связи или только парноэлектронные, или только донорно-акцепторного типа. Например, комплексы Fe3+ со щавелевой кислотой; Сu2+ c этилендиамином
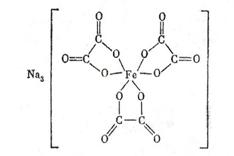

натрия триоксалатоферрат(III) этилендиаминмедь(II) хлорид
Наличие в хелатах циклических группировок сильно увеличивает их устойчивость по сравнению с соединениями подобного состава, но не имеющими циклов. Такое повышение устойчивости называется хелатным эффектом. Известны хелаты, которые не разлагаются даже при 500 оС. Разновидность хелатов – внутрикомплексные соединения – это такие хелаты, в которых один и тот же лиганд связан с комплексообразователем как обычной, так и координативной связью. К внутрикомплексным соединениям относятся, например, гликолят меди. В реакции гидроксида меди с аминоуксусной кислотой (глицин) образуется нейтральный комплекс

Каждая молекула глицина использует обе функциональные группы. В одном случае она связывается с центральным атомом через азот аминогруппы по донорно-акцепторному механизму, а во втором – через кислород карбоксильной группы обычной ковалентной связью.
Первым внутрикомплексным соединением, нашедшим применение в химии, был диметилглиоксимат никеля, открытый Л.А. Чугаевым в 1905 г. Это соединение не растворимо в воде и обладает ярко-красным цветом. Реакция с диметилглиоксиматом очень чувствительна и с успехом применяется для количественного определения никеля

В диметилглиоксимате имеется четыре цикла: два пятичленных и два шестичленных. Образование последних обусловлено водородной связью.
В последние годы широкое применение нашли внутрикомплексные соединения на основе этилендиаминтетрауксусной кислоты (ЭДТА) и других аминополикарбоновых кислот и их натриевые соли, называемые комплексонами. Они образуют весьма прочные комплексные соединения с большинством катионов (Ca2+, Mg2+, Pb2+, Zn2+, Cd2+ и т.д.). С ионами тяжелых металлов комплексоны образуют устойчивые комплексные соединения, которые не обладают вредным действием, присущим ионам металлов, что позволяет использовать трилон Б как антидот в химической промышленности при отравлениях тяжелыми металлами.
Метод анализа с использованием комплексонов (ЭДТА и трилона Б) – комплексонометрия используется в аналитической химии для определения жесткости воды, содержания металлов в различных материалах.
Источник: studopedia.ru
На рынке присутствуют разнообразные формы комплексных соединений металлов, используемых в кормлении животных. Все эти разнообразные формы называют «органическими микроэлементами», поскольку входящие в их состав микроэлементы образуют комплексы, или другие типы химических соединений, с органическими молекулами.
Химические процессы комплексообразования, или образования хелатов, понимаются по-разному различными специалистами отрасли кормопроизводства, что приводит к возникновению путаницы в терминах и интерпретации свойств продуктов. Часто встречаются такие термины, как «комплекс металла и аминокислот», «хелат металла и аминокислот», «комплекс металла с полисахаридом», «протеинат металла», однако официальные определения этих терминов расплывчаты и не проясняют ситуацию. В качестве примера в Таблице 1 приведены различные определения органических микроэлементов, используемых в сельском хозяйстве, в формулировках Ассоциации американских контролёров качества кормов (AAFCO, 1998).
Таблица 1. Органические комплексы минералов – определения терминов в формулировках AAFCO.
|
Комплекс металла и аминокислоты – продукт, образующийся при формировании комплекса между растворимой солью металла и аминокислотой. |
|
Хелат металла и аминокислоты — продукт, образующийся в результате реакции иона металла из растворимой соли металла с аминокислотами при молярном соотношении, составляющем один моль металла к одному – трём (предпочтительно, двум) молям аминокислот, с образованием ковалентно-координационных связей. Средняя молекулярная масса гидролизованных аминокислот должна составлять примерно 150, а молекулярная масса образовавшегося хелата не должна превышать 800. |
|
Комплекс металла с полисахаридом — продукт, образующийся при формировании комплекса между растворимой солью и растворённым полисахаридом. |
|
Протеинат металла — продукт, образующийся при образовании хелатов между растворимой солью и аминокислотами и/или частично гидролизованным белком. |
Чтобы разобраться в запутанных определениях, характеризующих химические и физические свойства микроэлементов, прежде всего, необходимо выявить отличия между терминами «комплекс» и «хелат».
Комплексы или хелаты
Термин «комплекс» может использоваться при описании соединений, образующихся при взаимодействии иона металла с молекулой или ионом (лигандом), которые обладают свободной парой электронов. Такие ионы металлов связываются с лигандом посредством атомов-доноров, например, кислорода, азота или серы. Лиганды, обладающие только одним атомом-донором, называются монодентатными, а лиганды, обладающие двумя и более атомами-донорами, называеются би-, три- или тетрадентатными, также их иногда называют полидентатными.
Когда такие лиганды связываются с ионом металла посредством двух и более атомов-доноров, образуется комплекс, состоящий из одного или более гетероцикличных колец, в состав которых входит атом металла. Такие комплексы называются «хелаты» (от греческого «chele» — клешня краба).
Аминокислоты являются бидентатными лигандами, образующими связи с ионами металла посредством кислорода карбоксильной группы и азота аминогруппы.
Этилендиаминтетрауксусная кислота (ЭДТА) является примером гексадентатного лиганда, который содержит шесть атомов-доноров. ЭДТА образует очень прочные комплексы с большинством ионов металлов, и не очень подходит для образования хелатов минералов, поскольку биологическая доступность таких комплексов невысока.
Хотя могут образовываться хелаты, содержащие четыре, пять, шесть или семь колец, установлено, что наиболее стабильными являются хелаты, содержащие пять колец.
Также необходимо помнить о том, что хотя хелаты и являются комплексами, не все комплексы являются хелатами. Несмотря на простоту теории, объясняющей образование хелатов, необходимо строгое соблюдение множества условий для получения стабильного хелата минерала.
Лиганд должен содержать два атома, способных образовывать связи с ионом металла.
Лиганд должен образовывать гетероциклическое кольцо, причём металл должен располагаться «в конце» этого кольца.
Образование хелата металла должно быть пространственно (стерически) возможно. Для достижения стабильности необходимо соблюдать соотношение количества лиганда к минералу.
Истинные хелаты имеют «кольцевую структуру», образованную ковалентно-координационной связью между аминной и карбоксильной группами аминокислоты и ионом металла.
Как правило, хелаты образуются в результате реакции между неорганическими солями минералов, с приготовленной при помощи ферментов смесью аминокислот и небольших пептидов в контролируемых условиях. Такие аминокислотные и пептидные лиганды связываются с ионом металла не в одной точке, а в нескольких, в результате чего атом металла становится частью биологически стабильной кольцевой структуры. Аминокислоты и продукты ферментативного разрушения белков, например, небольшие пептиды, являются идеальными лигандами, поскольку они обладают как минимум двумя функциональными группами (аминной и гидроксильной), необходимыми для образования кольцевой структуры с минералом. Только «переходные элементы», например, медь, железо, марганец и цинк обладают необходимыми физико-химическими характеристиками, позволяющими им образовывать ковалентно-координационные связи с аминокислотами и пептидами с образованием биологически стабильных комплексов.
Аминокислоты и пептиды в качестве лигандов
Существуют различные мнения относительно преимуществ использования аминокислот в сравнении с пептидами при образовании хелатов минералов, ещё больше споров имеется по вопросу биологической доступности таких продуктов. Мы уже рассмотрели общие условия, необходимые для образования биологически стабильных хелатов минералов, однако следует также учитывать и другие факторы, оказывающие влияние на образование хелатов, основными из этих факторов являются:
- Состояние равновесия между количеством ионов металла и количеством лиганда.
- Кинетика реакций замещения между гидратированными ионами металла и имеющимися комплексами.
- Окислительно-восстановительные свойства иона металла и его комплексов.
- Реакции с участием координированных лигандов.
Очевидно, что такой сложный химический феномен не следует чрезмерно упрощать. Однако чтобы прояснить ситуацию касательно преимуществ аминокислот либо пептидов в процессе образования хелатов минералов, мы рассмотрим факторы, влияющие на состояние равновесия и стабильность таких комплексов.
При растворении в воде соли металла, например, сульфата меди (II), с добавлением аминокислоты в качестве бидентатного лиганда, образуется ряд комплексов, каждый из которых обладает собственной константой стабильности, которая зависит от рН раствора. Это показано на Рисунке 1 (реакция сульфата меди (II) с глицином). Из данных, показанных на этом рисунке можно сделать некоторые важные выводы:
- Количество различных содержащих металл соединений при заданных концентрациях металла и аминокислоты зависит от рН раствора.
- Хелаты ионов металла с двойным положительным зарядом не всегда нейтральны.
- Различные ионы металла обладают различными константами стабильности, поэтому количество металла в составе определённых соединений зависит не только от величины рН раствора, но и от константы стабильности комплекса.
Рисунок 1. График изменения содержания меди, включённой в состав различных соединений, при изменении рН в растворе, содержащем медь (II) (0,001М) и глицин (0,002М). Горизонтальная ось: рН. Вертикальная ось: % Cu++

pH
У различных ионов металлов различные константы стабильности. Поэтому, количество металла, входящего в состав конкретного соединения, зависит не только от величины рН раствора, но и от константы стабильности комплекса.
Стабильность содержащего металл комплекса зависит как от свойств металла, так и от свойств лиганда. Увеличение заряда иона, уменьшение размера и увеличение аффинности электронов способствует большей стабильности. На стабильность комплексов влияют также некоторые характеристики лигандов: (1) щёлочность лиганда, (2) количество металло-хелатных колец на единицу лиганда, (3) размер хелатного кольца, (4) пространственные эффекты, (5) резонансные эффекты и (6) атом лиганда. Поскольку комплексные соединения образуются в результате кислотно-основных реакций, как правило, более щелочные лиганды образуют более стабильные комплексы. Также большое значение имеет размер хелатного кольца.
Ещё глубже проанализировав Рисунок 1, можно заметить наличие существенных отличий между относительной стабильностью хелатов металлов, образованных аминокислотами и стабильностью протеинатов металлов. Поскольку протеинат металла является продуктом реакции хелатообразования между растворимой солью и аминокислотами и/или частично гидролизованным белком, можно предположить, что для конкретного иона металла количество графиков, характеризующих образование различных соединений, в состав которых входит металл, при образовании протеината, будет намного больше, чем при образовании хелата этого же металла с аминокислотой. Если считать график, отражающий распределение количества меди между различными соединениями, индикатором относительной стабильности при данной величине рН, и учитывать бесконечное количество комбинаций, возможных в результате взаимодействия как отдельных аминокислот, так и ди-, три- и даже тетрапептидов, то, теоретически, общая стабильность протеината в широком диапазоне рН должна быть намного больше, чем стабильность хелата данного металла с аминокислотой.
Биологическая стабильность
Очевидно, что в реальных условиях рассмотренные дополнительные факторы будут оказывать влияние на стабильность хелата. Однако можно ожидать, что протеинаты металлов будут обладать физико-химическими свойствами, необходимыми для сохранения постоянства характеристик при изменении рН.
Несмотря на наличие некоторой противоречивой информации, образование хелатов металлов – это не такой уж сложный процесс, в основе которого лежат фундаментальные законы химии. Мы можем выделить две формы истинных хелатов минералов, каждая из которых обладает определёнными химическими и биофизическими свойствами. Внимательно изучив факторы, влияющие на образование хелатов минералов, можно выявить различия между продуктами по показателю биологической стабильности и, следовательно, биологической доступности.
Источник: www.dairynews.ru
Хелатирование
Хелатообразование (хелатирование) — это достаточно популярный процесс в химии, медицине и даже в живой природе. Без образования хелатов не обходятся биохимические процессы: фотосинтез, доставка кислорода кровью, доставка ионов через мембрану клеток и даже процессы сокращения мышц.
В ежедневной жизни хелатирование используется в следующих целях:
- для удаления накипи в бойлерах;
- для смягчения воды;
- для лечения отравления свинцом и рядом других металлов;
- в химических анализах;
- в консервировании продуктов;
- в косметике и многих других отраслях.
Откуда берутся ионы металлов в косметике и как они влияют на работу продукта?
Следы ионов металлов можно обнаружить почти везде, при этом даже незначительное их количество может вызвать изменение цвета и свойств продукта. Даже при идеальных производственных условиях ионы металлов могут попасть в косметику с оборудования, контейнеров для хранения, систем водоснабжения или натуральных косметических компонентов. И если их количество не корректировать, могут происходить медленные реакции внутри упаковки с продуктом, что приведет к его порче. Так, например:
- некоторые отдушки, могут изменять запахи и разлагаться,
- витамины и незаменимые жирные кислоты могут разлагаться,
- со временем могут меняться цвета продуктов,
- жиры могут прогоркать,
- прозрачный продукт может становиться мутным,
- однородные косметические составы могут расслаиваться,
- окислители и активаторы могут становиться нестабильными.
Также ионы металлов приводят к тому, что моющие и ополаскивающие средства, значительно хуже пенятся, особенно в жесткой воде.
При окрашивании волос ионы металлов могут мешать полезным реакциям перекиси водорода, уменьшать стойкость цвета окрашенных волос и даже способствовать разрушению пигментов. А при работе осветляющих веществ ионы металлов, могут давать нежелательные оттенки на блонде и мешать процессу осветления.
Особенности работы хелатов в косметике
Образование хелатов позволяет «обезвредить» ионы металлов без необходимости их полного удаления. Для применения хелатирующего шампуня не нужно очищать воду из крана от ионов металлов — все сделают сами хелатообразующие вещества при контакте с остатками воды из под крана у вас на волосах. В результате изолирования концентрация ионов металла значительно снизится, при этом хелаты, которые образуются, уже не мешают никаким дальнейшим реакциям. Благодаря этому большая часть косметики для волос хорошо работает в разных условиях жесткости воды. Хелатирующие компоненты входят практически во всю смываемую косметику для волос: краски, окислители, средства для осветления волос, химические завивки, шампуни, кондиционеры и маски. А вот в несмываемых продуктах (жидкие кристаллы или средства для укладки) в них нет необходимости, так как ионы металлов им не мешают.
Некоторые хелатирующие вещества усиливают действие консервантов. Они блокируют доступ питательных веществ к микробам, благодаря чему продукты дольше хранятся.
В зависимости от фирмы производителя в косметике могут быть использованы совершенно разные хелатообразующие вещества в разных концентрациях. В основном все косметические бренды плюс минус одинаково работают в условиях жесткой воды, однако, все же встречаются косметические бренды, которые могут быть чуть более эффективны или чуть менее эффективны в условиях соленой или жесткой воды. Особенно это заметно по стойкости цвета краски для волос в тех регионах, где вода содержит много ионов металлов.
Наиболее популярные в косметике вещества из этой группы: Etidronic Acid, Tetrasodium EDTA, Disodium EDTA, EDTA, Pentasodium Pentetate и целый ряд других веществ. Подобными свойствами помимо целого ряда других полезных свойств могут обладать некоторые вещества типа лимонной кислоты (Citric Acid), что широко используется при производстве окислителей и активаторов.
Хелатирующие шампуни
Хелатирующие шампуни предназначены для удаления избытков солей металлов с волос. Это шампуни с повышенным содержанием веществ, которые образуют хелаты с ионами металлов в волосах. В результате их применения минеральные накопления быстро вымываются и не мешают парикмахерским процедурам.
Это относительно новая группа шампуней. Их можно встретить только у отдельных брендов, например, Joico K-Pak Chelating Shampoo или L’ANZA Ultimate Treatment Chelating Shampoo.
Чем отличаются хелатирующие шампуни от шампуней глубокой очистки?
Очень часто шампуни глубокой очистки и хелатирующие шампуни путают и пытаются взаимозаменять, но нужно понимать, что все же это разные продукты и они не могут на 100% заменить друг друга.
Обычные шампуни глубокой очистки в основном работают с остатками косметики на волосах и жировыми накоплениями, однако если в волосах накопились соли после морской воды, то шампуни глубокой очистки малоэффективны. Приходится многократно мыть волосы или ждать пару недель, пока накопления вымоются естественным путем.
Хелатирующие шампуни — по факту это шампуни с повышенным содержанием веществ, которые образуют хелаты с ионами металлов в волосах, и как следствие эти минеральные накопления быстро вымываются и не мешают парикмахерским процедурам.
Представьте, пришел клиент на окрашивание или завивку после отдыха на море, где, благодаря морской воде, его волосы набрали огромное количество минеральных солей. Эти соли будут мешать проведению всех процедур. Шампунь глубокой очистки только разрыхлит волосы и может за 1—2 применения не вымыть все минеральные накопления, а вот хелатирующий шампунь справится быстро и эффективно. И далее при нанесении краски или составов для химической завивки ничего не будет мешать работе продуктов.
Следует знать, что хелатирующим шампунем вымываются только минеральные соли, которые привнесены извне — сам шампунь особо не влияет на структуру и состав волоса, и в отличии от шампуней глубокой очистки он имеет более мягкую моющую композицию, гораздо меньше разрыхляет волосы и хуже вымывает накопления косметики на волосах.
Источник: haircolor.org.ua
Микроэлементы в жизни растений
Микроэлементы – элементы питания растений, столь же необходимые для их нормальной жизнедеятельности, как и основные компоненты (калий, магний, фосфор и др.). Их отличие от последних состоит лишь в том, что требуются они организму в микроскопических количествах, отсюда и название. Соответственно и удобрения, содержащие микроэлементы, именуются микроудобрениями.
Для растений выделяют семь важнейших микроэлементов:
- Fe (железо);
- Mn (марганец);
- Cu (медь);
- Zn (цинк);
- B (бор);
- Mo (молибден);
- Co (кобальт).
Они принимают самое непосредственное участие в биохимических процессах в растениях – влияя на обмен и транспорт макроэлементов, участвуя в синтезе хлорофилла, активизируя ферменты… Кроме этого, микроэлементы играют важную роль в нормальном росте и развитии растения, его устойчивости к заболеваниям и неблагоприятным факторам окружающей среды, урожайности в конечном итоге.
Недостаток того или иного микроэлемента можно обнаружить даже визуально, если нет возможности сделать анализ почв:
- при нехватке железа активно желтеют листья, формируются мелкие и слабые соцветия, усыхают кончики ветвей и побегов;
- при недостатке бора подавляется рост почек и молодых листьев, они усыхают и опадают, растрескиваются стебли, темнеют и мельчают корнеплоды;
- без достаточного количества марганца у растений наблюдается задержка роста, а листья светлеют и покрываются серыми пятнами, рано облетают;
- медное голодание характеризуется затормаживанием роста, искривлением и измельчанием соцветий и листьев, сильно страдает формирование семян и зерен;
- при нехватке кобальта нарушается азотный обмен, укорачивается цикл развития растений и замедляется их рост, скручиваются и опадают листья;
- если мало цинка – наблюдается хлороз, заторможенный рост (особенно корневой системы), плоды приобретают нетипичную окраску и уродливые формы;
- недостаток молибдена можно выявить по бледным пятнам и перфорации на листьях, их увяданию и скручиванию, измельчанию цветков и деформации соцветий.
Разумеется, в идеальном случае все микроэлементы должны содержаться прямо в почве и оттуда самостоятельно добываться растениями. Однако это – в идеале, который мы редко можем наблюдать на среднестатистическом дачном участке. К тому же в условиях интенсивного огородничества со временем истощаются даже самые богатые почвы – истощаются и требуют для получения качественного урожая внесения всех полезных веществ (в том числе и микроудобрений) извне.
Итак, микроудобрения растениям необходимы на протяжении всего периода роста – начиная с этапа прорастания семян и вплоть до сбора урожая. Какие же микроудобрения выбрать из множества существующих?
Ранее в состав большинства удобрений микроэлементы входили в виде растворимых неорганических солей. Увы, в таком виде усваивались они растениями весьма слабо – не более чем на 20-35%! Соли эти могли вступать в перекрестные реакции в почве с образованием неусвояемых соединений. К тому же некоторые из них даже токсичны, а еще – требуют дополнительной переработки почвенными микроорганизмами. А из-за низкой усвояемости приходится регулярно вносить достаточно большие дозы таких удобрений, неотвратимо засоляя почвы. Это сложно и неэффективно.
Но, к счастью, прогресс не стоит на месте. И сегодня производителю есть что предложить садоводам-огородникам в этом плане. Например, удобрения в форме хелатов.
Хелатные минеральные удобрения
Хелаты для растений – неоценимые помощники, они позволяют усваивать микроэлементы практически на 90%, что позволяет в несколько раз снизить химическую нагрузку на почву! За счет чего?
Хелат (от греческого chele ,»клешня») – сложный органический комплекс, химическое соединение микроэлемента с хелатирующим (захватывающим) агентом. Такой агент прочно удерживает ионы микроэлементов в растворимом состоянии вплоть до момента поступления в растение, а затем высвобождает его, переводя в биологически доступную форму, и сам распадается на химические соединения, легко усваиваемые растениями.
Комплексы эти биологически активны и близки по своей структуре к природным веществам (например, хлорофилл или витамин В12 по своей природе являются хелатами), поэтому безвредны и эффективны для растения, особенно молодого. Они не связываются в почве и не вступают в сторонние реакции. Именно на основе хелатов созданы препараты нового поколения для предпосевной обработки семян, последующих внекорневых подкормок растений и капельного орошения.
В различных удобрениях используются разные хелатирующие агенты, которые могут различаться по силе связывания ионов и по стабильности в среде той или иной кислотности. Поэтому при выборе хелатного удобрения нужно учитывать, для каких именно растений и в каких почвах предстоит его использовать:
- ЕДТА стабилен при рН 1,5- 6,0;
- ДТРА стабилен при рН 1,5-7,0;
- ЕДДНА стабилен при рН 3,0-10;
- ОЭДФ стабилен при рН 4,5-11.
Когда использовать хелатные удобрения?
Хелатные удобрения могут быть «одиночными», включая лишь один микроэлемент (например, Fe-ЭДТА или Fe-ДТПА), а могут быть и комплексными (например, водный раствор хелатов микроэлементов Mn, Zn, Cu, Mo на основе ОЭДФ). Выбирать те или иные нужно, учитывая состояние растений и почвы именно на вашем участке.
Как правильно использовать хелатные удобрения? Общие рекомендации сводятся к тому, чтобы вносить хелаты в особенно важные для растения периоды жизни, чтобы действенно помочь им:
- Для предпосевной обработки семян (протравливание, замачивание). В результате мы одновременно и обеззараживаем семена, и повышаем их всхожесть и энергию прорастания.
- Для обработки и пересаживания рассады. В результате улучшается ее всхожесть и приживаемость, повышается устойчивость к стрессовым факторам внешней среды и заболеваниям. Хелаты особенно важны на начальных стадиях развития, когда корневая система еще не окрепла.
- Для обработки растения во время цветения. Получаем в результате ускорение цветения и завязи плодов, увеличение количества завязей, повышение иммунитета против вирусных заболеваний.
- Для совместной обработки с пестицидами, чтобы снять стресс у растения после применения ядохимикатов и для профилактики грибковых заболеваний и хлороза.
- Для обработки «по плодам». В результате получаем заметное увеличение урожайности, улучшение качественных показателей плодов (сахаристость, содержание крахмала и т.п.), увеличение срока хранения продукции и даже снижение уровня нитратов в ней.
Разумеется, используются хелаты не только для огородных растений. Комнатные и садовые цветы также будут вам благодарны за такую подкормку. Например, большой популярностью у опытных садоводов пользуются хелатные удобрения для роз, которые заметно улучшают их качество и товарный вид цветов.
Как использовать удобрения-хелаты?
Наибольший эффект дает применение хелатных микроудобрений для обработки семян с последующей внекорневой и корневой подкормкой (в течение всего вегетационного периода, как мы упоминали выше). К тому же микроудобрения в хелатной форме можно вносить одновременно с другими макроудобрениями и ядохимикатами, если нет противопоказаний по совместимости веществ.
Обязательно читайте инструкцию по применению хелатов – производитель указывает на упаковке важные данные по особенностям состава и применения препарата!
В какой же форме и как употребляют хелатные микроудобрения.
- В виде раствора для предпосевного замачивания семян.
- В виде корневой подкормки. Полив под корень имеет лишь один недостаток – часть микроэлементов может уйти с избытком влаги глубоко в землю, где будет недоступна для растения.
- В виде внекорневой (листовой) подкормки – при попадании на поверхность листа микроэлементы в составе хелатного комплекса способны легко попасть внутрь, где удобрение отдаст питательные элементы растению.
- В виде капельного полива (орошения) – метод весьма действенный, так как микроудобрения непосредственно доставляются к корням.
Хелатные удобрения своими руками
В продаже чаще всего вы увидите жидкие хелатные удобрения. Преимущество таких водных растворов микроэлементов заключается в удобстве их применения – легко отмерять готовый рабочий раствор хелатов, легко его использовать (тогда как хелаты в сыпучей форме придется еще растворять согласно инструкции, ведь в сухом виде они неэффективны).
При желании вы можете изготовить хелатные моноудобрения и в домашних условиях. Расскажем технологию на примере наиболее востребованных железосодержащих хелатных удобрений:
- 8 г медного купороса растворите в 2 л теплой дистиллированной воды;
- отдельно в таком же количестве воды растворите 5 г лимонной кислоты;
- первый раствор влейте во второй тонкой струйкой, постоянно помешивая;
- к полученной смеси, так же помешивая и тонкой струйкой добавьте еще 1 л воды;
- получается 5 л 0,5%-ного раствора, который нужно использовать немедленно.
Точно так же готовится хелат меди – в качестве исходных веществ используются 20 г медного купороса и 40 г аскорбиновой кислоты.
Напомним лишь, что домашние удобрения за счет большого количества балластных веществ подойдут скорее для профилактических обработок, чем для принятия срочных мер по лечению, к примеру, того же хлороза. К тому же они не хранятся и не допускают дальнейшего разведения.
Итак, хелатные удобрения безопасны, высокоэффективны и удобны в применении. Они улучшают усвояемость основных питательных элементов и заметно помогают растениям. Единственным их недостатком можно назвать лишь повышенную цену – производство стоит достаточно дорого. Однако достоинства удобрений в хелатной форме с избытком покрывают этот изъян, надеемся, мы вам это доказали.
Источник: www.ogorod.ru
