Как выглядит калий
| K | 19 |
| 39,0983 | |
| 4s1 | |
| Калий | |
Калий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются. История и происхождение названия калий
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
В 1807 году английский химик Дэви электролизом твёрдого едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Присутствие в природе калия
В свободном состоянии не встречается. Калий входит в состав сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль).
Калий — получение калия
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
K+ + e− → K
2Cl− − 2e− → Cl2
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
4OH− − 4e− → 2H2O + O2
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Физические свойства калия
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Химические свойства калия
Калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, легко отдаёт электроны.
Является сильным восстановителем. Он настолько активно соединяется с кислородом, что образуется не оксид, а супероксид калия KO2 (или K2O4). При нагревании в атмосфере водорода образуется гидрид калия KH. Хорошо взаимодействует со всеми неметаллами, образуя галогениды, сульфиды, нитриды, фосфиды и т. д., а также со сложными веществами, такими как вода (реакция проходит со взрывом), различные оксиды и соли. В этом случае они восстанавливают другие металлы до свободного состояния.
Калий хранят под слоем керосина.
Оксиды калия и пероксиды калия
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
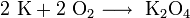
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:

Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:

Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Гидроксиды калия
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого калия при 20 °C в 100 г воды составляет 112 г.
Применение калия
- Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава натрий 12 %, калий 47 %, цезий 41 % обладает рекордно низкой температурой плавления −78 °C.
- Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений.
- Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
Важные соединения
- Бромид калия — применяется в медицине и как успокаивающее средство для нервной системы.
- Гидроксид калия (едкое кали) — применяется в щелочных аккумуляторах и при сушке газов.
- Карбонат калия (поташ) — используется как удобрение, при варке стекла.
- Хлорид калия (сильвин, «калийная соль») — используется как удобрение.
- Нитрат калия (калийная селитра) — удобрение, компонент чёрного пороха.
- Перхлорат и хлорат калия (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ, в гальванотехнике.
- Дихромат калия (хромпик) — сильный окислитель, используется для приготовления «хромовой смеси» для мытья химической посуды и при обработке кожи (дубление). Также используется для очистки ацетилена на ацетиленовых заводах от аммиака, сероводорода и фосфина.
- Перманганат калия — сильный окислитель, используется как антисептическое средство в медицине и для лабораторного получения кислорода.
- Тартрат натрия-калия (сегнетова соль) в качестве пьезоэлектрика.
- Дигидрофосфат и дидейтерофосфат калия в виде монокристаллов в лазерной технике.
- Пероксид калия и супероксид калия используются для регенерации воздуха на подводных лодках и в изолирующих противогазах (поглощает углекислый газ с выделением кислорода).
- Фтороборат калия — важный флюс для пайки сталей и цветных металлов.
- Цианид калия применяется в гальванотехнике (серебрение, золочение), при добыче золота и при нитроцементации стали.
- Калий совместно с перекисью калия применяется при термохимическом разложении воды на водород и кислород (калиевый цикл «Газ де Франс», Франция).
Биологическая роль
Природный калий состоит из трёх изотопов. Два из них стабильны: 39K (изотопная распространённость 93,258 %) и 41K (6,730 %). Третий изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251×109 лет. В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека весом 70 кг ежесекундно происходит около 4000 радиоактивных распадов. 40K считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (мощность оценивается в 44 ТВт). В минералах, содержащих калий, постепенно накапливается 40Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Источник: himsnab-spb.ru
Полезные свойства калия и его влияние на организм
Преимущества калия для здоровья:
Поддерживает здоровье головного мозга
Калий очень важен для здоровья нервной системы, которая состоит из головного и спинного мозга, а также нервов. Калий также играет роль в осмотическом балансе между клетками и межклеточной жидкостью. Это означает, что при недостатке калия, обмен жидкостей в организме нарушается. Расстройство нервной системы в сочетании с повышением артериального давления и церебральной жидкости из-за низкого содержания калия, может привести к сильным головным болям.
Снижение риска инсульта
Из-за роли калия в регуляции нервной системы, работы сердца и даже водного баланса, диета с высоким содержанием калия помогает снизить риск инсульта. Более того, было показано, что это преимущество сильнее, если калий поступает из натуральных пищевых источников, а не из добавок.
Улучшение здоровья сердца
Калий нужен для слаженной работы мышц. Циклы сокращения и расслабления мускулатуры, в том числе и сердца, зависят от метаболизма калия. Дефицит минерала может играть роль в развитии аритмии или нерегулярного сердцебиения.

Понижение кровяного давления
В человеческом организме существует механизм, известный как натриево-калиевый обмен. Он необходим для обмена веществ в клетках, баланса жидкостей и правильной работы сердца. Современный рацион питания чаще всего практически лишен калия и имеет в себе высокое количество натрия. Такой дисбаланс приводит к повышению кровяного давления.
Поддержка здоровья костей
Исследования показали, что калий, в изобилии содержащийся во фруктах и овощах, играет важную роль в улучшении здоровья костей. Было обнаружено, что калий уменьшает резорбцию кости – процесс, при котором кость разрушается. Следовательно, достаточное количество калия приводит к увеличению прочности костей.
Предотвращение мышечных судорог
Как было отмечено, калий необходим для работы мышц и регуляции жидкости в организме. Без достаточного количества калия в мышцах может случиться спазм. Кроме этого, регулярное употребление продуктов, богатых калием может помочь при менструальных болях.
Мало того, что употребление вкусных фруктов, овощей и бобовых, богатых калием, помогает предотвратить мышечные спазмы, оно также уменьшает мышечную слабость и усталость. Это обеспечивает большее количество энергии, чтобы двигаться в течение дня и максимально активно использовать свое время. Для спортсменов с более строгим спортивным графиком получение максимального количества калия из пищи поможет общей производительности. Это означает, что продукты, богатые калием, должны присутствовать в каждом приеме пищи и закусках, а также в концентрированных и восстановительных коктейлях.
Помощь в борьбе с целлюлитом
Мы часто ассоциируем наличие целлюлита с высоким потреблением жиров и низкой физической активностью. Однако, одним из основных факторов, помимо генетики, является также накопление жидкости в организме. Это происходит при повышенном потреблении соли и недостаточным потреблением калия. Попробуйте ввести в свой рацион на регулярной основе больше продуктов, богатых калием, и вы увидите, как уменьшится количество целлюлита и улучшится общее состояние здоровья.
Поддержка здорового веса
Одним из наиболее важных преимуществ достаточного употребления калия, среди прочих, является его влияние на уровень здоровой массы тела. Такой эффект наблюдается потому, что калий помогает восстановиться ослабленным и усталым мышцам, улучшает здоровье сердца, помогает работе нервной системы и поддерживает баланс жидкостей в теле. Кроме этого, продукты, богатые калием, как правило, питательны и низкокалорийные – «вредной» пище в желудке просто не останется места.

Метаболизм калия
Калий является основным внутриклеточным катионом в организме. Хотя минерал обнаружен как во внутриклеточной, так и во внеклеточной жидкости, он более концентрирован внутри клеток. Даже небольшие изменения концентрации внеклеточного калия могут сильно повлиять на соотношение внеклеточного и внутриклеточного калия. Это, в свою очередь, влияет на нервную передачу, сокращение мышц и тонус сосудов.
В необработанных пищевых продуктах калий встречается главным образом в связи с предшественниками, такими как цитрат и, в меньшей степени, фосфат. Когда калий добавляется в пищу во время обработки или в витамины, он находится в форме хлорида калия.
Здоровый организм поглощает около 85 процентов потребляемого им пищевого калия. Высокая внутриклеточная концентрация калия поддерживается натрий-калий-АТФазным обменом. Поскольку его стимулирует инсулин, изменения концентрации инсулина в плазме могут влиять на внеклеточную концентрацию калия и, следовательно, концентрацию калия в плазме.
Около 77-90 процентов калия выводится с мочой. Это связано с тем, что в устойчивом состоянии корреляция между потреблением калия с пищей и содержанием калия в моче является достаточно высокой. Остальное выделяется в основном через кишечник, и гораздо меньшее количество выводится с потом[4].
Взаимодействие с другими микроэлементами:
- Хлорид натрия: калиq смягчает прессорный эффект хлорида натрия. Пищевой калий увеличивает выведение хлорида натрия с мочой.
- Натрий: калий и натрий тесно связаны между собой, и при неправильном соотношении двух элементов возможно повышение риска возникновения камней в почках и гипертонии[4].
- Кальций: калий улучшает реабсорбцию кальция, а также позитивно влияет на минеральную плотность костей.
- Магний: магний необходим для оптимального метаболизма калия в клетках, а правильное соотношение мания, кальция и калия может уменьшить риск возникновения инсульта[5].

Полезные сочетания продуктов с калием
Йогурт + банан: сочетание продуктов, содержащих калий, с протеинами помогает росту мышечной ткани и восстановлению аминокислот, которые теряются во время физической активности. Такое блюдо можно употреблять как на завтрак, так и в качестве снека после тренировки[8].
Морковь + тахини: морковь считается необыкновенно полезной – в ней содержатся здоровые углеводы, клетчатка, витамины А, В, К и калий. Тахини (паста из кунжута) также включает в себя большое количество витаминов и минералов, а также белки. Клетчатка, содержащаяся в тахини помогает снизить количество потребляемых калорий, а также имеет противовоспалительный эффект и поддерживает здоровье кишечника.
Оливки + помидоры: оливки выступают в качестве отличного источника клетчатки, которая поддерживает функционирование желудочно-кишечного тракта и стимулирует работу кишечника. В помидорах, в свою очередь, содержится уникальный антиоксидант ликопен, а также витамин А, железо и калий[7].
Правила готовки продуктов с калием
При пищевой обработке продуктов, содержащих калий, теряется достаточно большое его количество. Это связано с высокой растворимостью солей калия в воде. К примеру, вареный шпинат, с которого с помощью дуршлага убрали излишнюю жидкость, содержит на 17% процентов меньше калия, чем в сыром его варианте. А разница в количестве калия между сырой и вареной кудрявой капустой составляет практически 50%[1].

Применение в официальной медицине
Как показывают медицинские исследования, высокий уровень потребления калия имеет защитный эффект против ряда патологий, затрагивающих кардиоваскулярную систему, почки и скелет.
Кроме этого, существует все больше доказательств в пользу того, что увеличение количества калия в рационе положительно влияет на работу мышц, общее их состояние и на частоту падений[10].
Остеопороз
Положительная динамика в росте минеральной плотности костей была отмечена у женщин в возрасте пре-, пост- и менопаузы, а также пожилых мужчин, которые потребляли от 3000 до 3400 мг калия в день.
Продукты, богатые калием (фрукты и овощи), обычно также содержат множество предшественников гидрокарбонатов. Эти буферные кислоты находятся в организме, чтобы стабилизировать уровень кислотности. Западный рацион на сегодняшний день имеет тенденцию быть более кислым (рыба, мясо и сыры) и менее щелочным (фрукты и овощи). Чтобы стабилизировать рН организма, щелочные соли кальция в костях освобождаются для нейтрализации употребляемых кислот. Потребление большего количества фруктов и овощей с калием снижает общее содержание кислоты в рационе и может помочь поддерживать здоровый уровень кальция в костях.
Инсульт
Врачи связывают снижение частоты инсультов с более высоким потреблением калия, на что указывают несколько крупномасштабных эпидемиологических исследований.
В целом, данные свидетельствуют о том, что небольшое увеличение потребления продуктов, богатых калием, может значительно снизить риск инсульта. Это особенно актуально для людей с высоким кровяным давлением и/или относительно низким потреблением калия.

Заменители соли
Многие заменители соли содержат хлорид калия в качестве замены некоторого или всего количества хлорида натрия в соли. Содержание калия в этих продуктах колеблется в широких пределах — от 440 до 2800 мг калия на чайную ложку. Люди, страдающие заболеваниями почек или применяющие определенные лекарства, должны проконсультироваться со своим лечащим врачом, прежде чем принимать заменители соли из-за риска гиперкалиемии, вызванного высоким уровнем калия в этих продуктах[9].
Камни в почках
Существует повышенный риск почечных камней среди людей с высоким уровнем кальция в моче. Он также может быть связан с недостатком калия. Экскреция кальция с мочой может быть уменьшена за счет увеличения потребления кальция или за счет добавления бикарбоната калия[2].
В пищевых добавках калий часто присутствует в виде хлорида калия, однако также используются и многие другие формы — включая цитрат калия, фосфат, аспартат, бикарбонат и глюконат. На этикетке биологически активной добавки обычно указывается количество элементарного калия в продукте, а не масса всего калийсодержащего соединения. Некоторые пищевые добавки содержат йодид калия в микрограммовых количествах, но этот ингредиент служит формой минерального йода, а не калия.
Не все поливитаминные/минеральные добавки содержат калий, но те, в которых он есть, обычно включают в себя около 80 мг калия. Также доступны добавки, содержащие только калий, и большинство из них содержат до 99 мг минерала.
Многие производители и распространители пищевых добавок ограничивают количество калия в своих продуктах только до 99 мг (что составляет всего около 3% от рекомендованной нормы). Считается, что некоторые пероральные лекарственные препараты, которые содержат хлорид калия, небезопасны, поскольку они связаны с поражением тонкой кишки.

Калий при беременности
Калий играет важную роль в поддержании баланса жидкостей и электролитов в клетках организма. Кроме этого, он отвечает за отправление нервных импульсов, помогая сокращению мышц. Объем крови при беременности увеличивается до 50%, поэтому тело нуждается в большем количестве электролитов (натрий, калий и хлорид во взаимодействии) для поддержания правильного химического баланса в жидкостях. Если у беременной женщины наблюдаются судороги мышц ног, одной из причин может быть недостаток калия. При беременности, гипокалиемия может наблюдаться в первую очередь в связи с тем фактом, что женщина теряет много жидкости во время утренней тошноты в первые месяцы. Гиперкалиемия также является очень опасной при беременности, так она может привести к достаточно серьезным проблемам сердца. К счастью, на практике она встречается не так часто и связана в основном с почечной недостаточностью, употреблением алкоголя или наркотиков, экстремальным обезвоживанием и диабетом 1-го типа[11,12].
Применение в народной медицине
В народных рецептах калий играет важную роль при лечении болезней сердца, желудочно-кишечного тракта, остеопороза, нервной системы и почек.
Известным средством против многих болезней является раствор марганцовокислого калия (так называемая «марганцовка»). Его, например, народные лекари предлагают принимать при дизентерии – внутрь и в виде клизмы. Следует отметить, что данный раствор нужно применять с большой осторожностью, так как неверно подобранная доза или плохо размешанный раствор может привести к серьезным химическим ожогам[13].
Народные рецепты упоминают прием продуктов, богатых калием, при сердечных проблемах и нарушениях водного обмена. Одним из таких продуктов, к примеру, выступают пророщенные зерна. В них содержатся соли калия, а также множество других полезных микроэлементов[14].
Для здоровья почек народная медицина, среди прочего, советует употреблять виноград, богатый глюкозой и солями калия. Он также является хорошим средством при заболеваниях сердца, бронхов, печени, при подагре, нервном истощении и анемии[15].

Калий в последних научных исследованиях
- Травы, в том числе кинза, имеют долгую историю использования в качестве противосудорожных средств в народной медицине. До сих пор многие из основных механизмов работы трав оставались неизвестными. В недавнем исследовании ученые обнаружили новое молекулярное действие, которое позволяет кинзе эффективно задерживать определенные судорожные приступы, типичные для эпилепсии и других заболеваний. «Мы обнаружили, что кинза, которая используется как нетрадиционное противосудорожное лекарство, активирует класс калиевых каналов в мозге, которые снижают судорожную активность», — заявил Джефф Эбботт, доктор философии, профессор физиологии и биофизики в Медицинской школе Университета Калифорнии — Ирвин. «В частности, мы обнаружили, что один компонент кинзы, называемый додеканаль, связывается с определенной частью калиевых каналов, чтобы открыть их, снижая возбудимость клеток. Это конкретное открытие важно, поскольку оно может привести к более эффективному использованию кинзы в качестве противосудорожного средства, или модификации додеканаля для разработки более безопасных и более эффективных противосудорожных препаратов».
«Помимо противосудорожных свойств, кинза также имеет потенциал противоракового, противовоспалительного, противогрибкового, антибактериального, кардиозащитного, и обезболивающего эффектов», — добавили ученые [16]. - Не так давно было опубликовано новое исследование о причинах смертности от сердечно-сосудистых заболеваний. Ученые пришли к выводу, что недостаточное употребление овощей и фруктов приводит к невероятному количеству смертей каждый год – речь идет о миллионах людей. Было установлено, что примерно в 1 из 7 случаев смерть от заболеваний сердца и сосудов могла быть предотвращена своевременным введением в рацион достаточного количества фруктов, а в 1 из 12-ти – употреблением овощей. В свежих фруктах и овощах, как известно, содержится кладезь полезных веществ – клетчатка, калий, магний, антиоксиданты, фенолы. Все эти микроэлементы помогают поддерживать нормальный уровень кровяного давления и снижают уровень холестерина. Кроме этого, они поддерживают баланс бактерий в пищеварительном тракте. Люди, употребляющие большое количество свежих овощей и фруктов также реже страдают от ожирения или избыточного веса, и калий играет в этом одну из самых важных ролей. Учеными было установлено, что во избежание риска сердечно-сосудистых заболеваний, оптимальное количество фруктов, которые должны употребляться в день, составляет 300 грамм – а это примерно два небольших яблока. Что касается овощей, их в ежедневном рационе должно быть 400 грамм. Причем, наилучшим способом приготовления будет употребление в сыром виде. К примеру, для выполнения нормы, достаточно будет съесть одну сырую морковь среднего размера, и один помидор[17].
- Исследователям удалось определить причину недавно обнаруженного серьезного заболевания, которое вызывает у детей эпилептические припадки, потерю магния в моче и снижение интеллекта. Используя генетический анализ, исследователи обнаружили, что болезнь вызвана недавно возникшей мутацией в одной из четырех форм натриево-калиевого обмена, известного как натрий-калиевая аденозинтрифосфатаза. Новые знания о заболевании, вероятно, будут означать, что врачи в будущем будут более осведомлены о том, что дефицит магния в сочетании с эпилепсией может быть вызван генетическими дефектами натриево-калиевого метаболизма[18].

Для похудения
Традиционно калий не воспринимается как помощник в потере веса. Однако, с изучением его механизмов действия и функций, это мнение начинает постепенно меняться. Калий помогает в похудении с посредством трех основных механизмов:
- 1 Калий помогает улучшить метаболизм и количество энергии: он дает нашему организму компоненты, необходимые для обеспечения энергии во время физической активности и помогает ему использовать питательные вещества, повышающие метаболизм – железо, магний и кальций.
- 2 Калий помогает набрать мышечную массу: в сочетании с магнием, он помогает в сокращении и росте мышц. А чем сильнее мышцы, тем больше калорий они сжигают.
- 3 Калий предотвращает излишнее удержание жидкостей в организме: вместе с натрием, калий помогает поддерживать обмен жидкостей в теле, избыток которых также прибавляет количество килограммов на весах[20].
Использование в косметологии
Калий часто можно увидеть в составе разнообразных косметических средств. Существует множество форм, в которых он употребляется – калий аспартат, калий бикарбонат, калий бромат, калий касторат, калий хлорид, калий гидроксид, калий силикат, калий стерат и т.д. Данные соединения используются чаще всего в уходовой косметике, средствах для гигиены рта и средствах для волос. В зависимости от конкретного соединения, может выступать в роли кондиционера, регулятора кислотности, антисептика, стабилизатора, эмульгатора и загустителя. Калий лактат имеет увлажняющее действие благодаря своей способности связывать молекулы воды и продуктов распада аминокислоты под названием серин. Многие соединения калия в больших дозах могут вызвать раздражение и ожоги, а также быть канцерогенными [19].
Источник: edaplus.info
История и происхождение названия
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl. В 1807 году английский химик Дэви электролизом расплава едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Получение
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор: K+ + e— → K 2Cl— − 2e— → Cl2 При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород: 4OH— − 4e— → 2H2O + O2 Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Физические свойства
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Химические свойства
Элементарный калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, является сильным восстановителем. На воздухе свежий срез быстро тускнеет из-за образования плёнок соединений (оксиды и карбонат). При длительном контакте с атмосферой способен полностью разрушиться. С водой реагирует со взрывом. Хранить его необходимо под слоем бензина, керосина или силикона, дабы исключить контакт воздуха и воды с его поверхностью. С Na, Tl, Sn, Pb, Bi калий образует интерметаллиды.
Источник: edu.glavsprav.ru

